22/11/2019 - 11:03
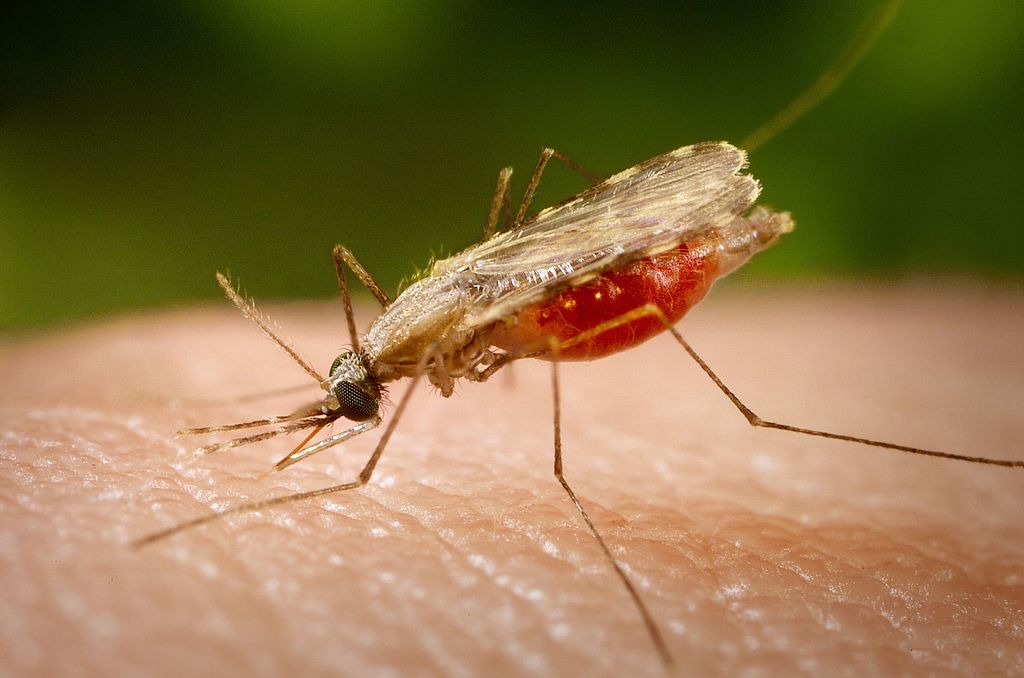
As bactérias que formam a microbiota intestinal influenciam processos importantes do organismo humano, como digestão, absorção de nutrientes e defesa contra patógenos. O mesmo tipo de relação está presente na maioria dos animais, inclusive no mosquito Anopheles darlingi, principal vetor da malária no Brasil.
No caso desse inseto, a composição da microbiota intestinal parece determinar a suscetibilidade à infecção pelo Plasmodium vivax – espécie responsável por 90% dos casos de malária no Brasil. Ou seja, quando o mosquito pica um humano doente, ocorre uma interação entre o parasita e as bactérias intestinais do inseto que é crucial para a continuação do ciclo de transmissão da doença.
Esta é a conclusão de um estudo conduzido na Universidade Estadual Paulista (Unesp) que será apresentado nesta sexta-feira (22/11) em Lyon, na França, durante o simpósio FAPESP Week France. Segundo os pesquisadores responsáveis, a descoberta permite pensar em estratégias para bloquear a transmissão da malária no vetor.
LEIA TAMBÉM: Travessia entre as Américas é garantia de aventura
“Descobrimos que, no intestino do Anopheles, a carga parasitária tem influência na composição da microbiota e vice-versa. Após investigar a relação parasita-bactéria mais a fundo, integrando dados da composição da microbiota a análises genéticas referentes à imunidade do mosquito, pretendemos realizar estudos de silenciamento de genes. O objetivo é desenvolver mosquitos imunes ao Plasmodium vivax, ou seja, que não se infectam e, consequentemente, não transmitem o parasita para os humanos”, disse Jayme Augusto de Souza-Neto, professor do Departamento de Bioprocessos e Biotecnologia da Faculdade de Ciências Agronômicas da Unesp de Botucatu e coordenador do projeto apoiado pela FAPESP.

Sistema imune é a chave
Trata-se do primeiro estudo a analisar de forma integrada o transcriptoma (o conjunto de genes expressos) e a microbiologia do Anopheles darlingi infectado pelo Plasmodium vivax.
Um trabalho anterior, realizado por outro grupo de cientistas com mosquitos Anopheles gambiae infectados por protozoários da espécie Plasmodium falciparum, havia demonstrado que a microbiota influencia o desenvolvimento do parasita dentro do mosquito. Ao comparar insetos com e sem bactérias no intestino, constatou-se, na época, que a microbiota como um todo interfere no desenvolvimento do protozoário. Descobriu-se que, quando não há bactérias (quando elas são eliminadas com antibióticos, por exemplo), o Plasmodium tende a se desenvolver com mais facilidade no organismo do inseto vetor.
O trabalho realizado na Unesp avança ao demonstrar que não só a presença de bactérias no intestino, mas, sobretudo, a composição dessa microbiota parecem ser determinantes na intensidade da infecção.
“Nos grupos de mosquitos com baixa infecção de parasita, observamos também uma baixa quantidade de bactérias e uma resposta imunológica alta. Já nos grupos com alta infecção de parasitas, houve uma alta quantidade de bactérias e uma resposta imunológica baixa”, contou Souza-Neto.
Atuação coordenada
Os pesquisadores também compararam as respostas transcricionais (o perfil de expressão dos genes), a carga e a composição da microbiota intestinal dos mosquitos. “Existe diferença na composição da microbiota entre os grupos de insetos com alta e baixa carga parasitária. Provavelmente, isso tem relação com a resposta imunológica, que também é diferente nesses dois grupos”, disse.
A microbiota dos mosquitos estudados era composta basicamente por cepas variadas de duas famílias de bactérias: as Enterobacteriales e as Flavobacteriales. “Existe uma dinâmica. Quando aumenta a carga parasitária, algumas bactérias específicas se tornam mais abundantes e outras, menos. Parece que elas atuam nesse processo de maneira bem coordenada”, contou o pesquisador.
De acordo com Souza-Neto, como a resposta imune é compartilhada entre bactérias e parasita, a defesa contra o parasita também atinge as bactérias e vice-versa. “Ao observarmos essa interação bactéria-parasita, percebemos que, de modo geral, as cargas bacteriana e parasitária seguem exatamente a mesma tendência. A explicação parece estar relacionada ao perfil de expressão dos genes ligados ao sistema imune do mosquito”, disse.
“O transcriptoma estava associado ao sistema complemento [proteínas que fazem parte do sistema imunológico dos invertebrados] do mosquito. Estudos anteriores já relacionaram a resposta contra o parasita com o sistema complemento. Nosso interesse é encontrar genes que, quando superexpressos, tornem o mosquito refratário à infecção pelo protozoário, de modo que ele não possa também transmitir o parasita para os humanos”, disse.
Modificar a população
Outra possível explicação estaria na resposta da microbiota ao parasita. “As bactérias produzem proteínas, metabólitos ou moléculas com ação antiparasitária. É possível que espécies reativas de oxigênio, como o peróxido de hidrogênio, por exemplo, ajudem a matar o Plasmodium, e que essa ação direta ocorra de modo independente e simultâneo ao sistema imune do mosquito”, disse.
A descoberta possibilita, no futuro, desenvolver estratégias de modificação de população, como liberar na natureza mosquitos transgênicos imunes ao parasita da malária. A abordagem é diferente da supressão populacional, tentada recentemente no combate à dengue, que consiste em liberar machos estéreis da espécie Aedes aegypti.
“Essa estratégia seria interessante principalmente para o Brasil, onde o Anopheles darlingi é o principal vetor da malária, mas também para outros países da América do Sul”, disse Souza-Neto.
O simpósio FAPESP Week France acontece entre os dias 21 e 27 de novembro, graças a uma parceria entre a FAPESP e as universidades de Lyon e de Paris, ambas da França. Leia outras notícias sobre o evento em www.fapesp.br/week2019/france/.