06/01/2022 - 10:37
Na última década, o sistema de edição de genoma CRISPR revolucionou a biologia molecular, dando aos cientistas a capacidade de alterar genes dentro de células vivas para pesquisas ou aplicações médicas. Agora, pesquisadores do Gladstone Institute of Data Science and Biotechnology (EUA) ajustaram um sistema adicional para edição de genes mais eficiente, usando moléculas chamadas retrons.
Segundo o grupo relatou em artigo publicado na revista Nature Chemical Biology, os retrons podem ser otimizados para eficiência e usados para editar genes em uma variedade de tipos de células, de fungos a células humanas.
- DNA em obras
- Pesquisadores criam método que armazena informações de células no DNA
- Jennifer Doudna: ‘A medicina de precisão está perto de virar padrão de atendimento’
“Este trabalho realmente consolida os retrons como uma plataforma que pode ser usada em organismos”, disse o pesquisador assistente Seth Shipman, autor sênior do novo estudo. “Podemos fazer modificações precisas nos genes de maneira mais fácil, rápida e eficiente do que com as abordagens atuais.”
Processo simplificado
A maioria das tecnologias atuais de edição de genes com base no sistema CRISPR envolve o corte de uma seção do DNA do genoma de uma célula e, em seguida, a introdução de um novo material genético chamado “molde de DNA” para substituí-lo. À medida que a célula repara os locais onde um gene existente foi cortado, o molde de DNA é integrado.
Esse molde é normalmente produzido no laboratório e então introduzido nas células. A proteína que corta o genoma da célula – chamada Cas9 – é inserida separadamente. Nem Cas9 nem o molde de DNA penetram em todas as células, o que limita a eficiência da edição do gene CRISPR.
Os retrons, no entanto, agem como fábricas de DNA, produzindo cópias abundantes de molde de DNA dentro das células. Além disso, os retrons podem ser inseridos junto com o resto dos componentes CRISPR a fim de que as células obtenham todo o material necessário para a edição de genes simultaneamente – os códigos genéticos para o molde de DNA, Cas9 e moléculas que ajudam os pesquisadores a rastrear as edições que foram feitas.
“Isso significa que só temos que introduzir um elemento em cada célula”, afirmou Santiago Lopez, aluno de pós-graduação no laboratório de Shipman e primeiro autor do novo artigo. “Isso simplifica significativamente o processo e abre a porta para novos tipos de experimentos.”
Mecanismos de defesa
Tanto os retrons quanto o CRISPR se originam de bactérias. Ambos são mecanismos de defesa que as bactérias usam para alterar o DNA em resposta a infecções. Após o advento da edição do genoma CRISPR, em que o sistema CRISPR foi cooptado para direcionar seletivamente genes em outros tipos de células, alguns pesquisadores começaram a sondar se retrons poderiam ser usados para fornecer os moldes para a edição precisa de genes. No entanto, os papéis das diferentes seções da estrutura do retron em sua função – e como ajustar essas seções para melhorar os retrons – eram desconhecidos.
“O sistema retron evoluiu para ajudar a defender as bactérias”, disse Shipman, que também é professor assistente de bioengenharia e ciências terapêuticas na Universidade da Califórnia em San Francisco (UCSF). “Mas queríamos mudar o que faz normalmente para o que queremos fazer –produzir modelos para edição de genes.”
Reengenharia de retrons
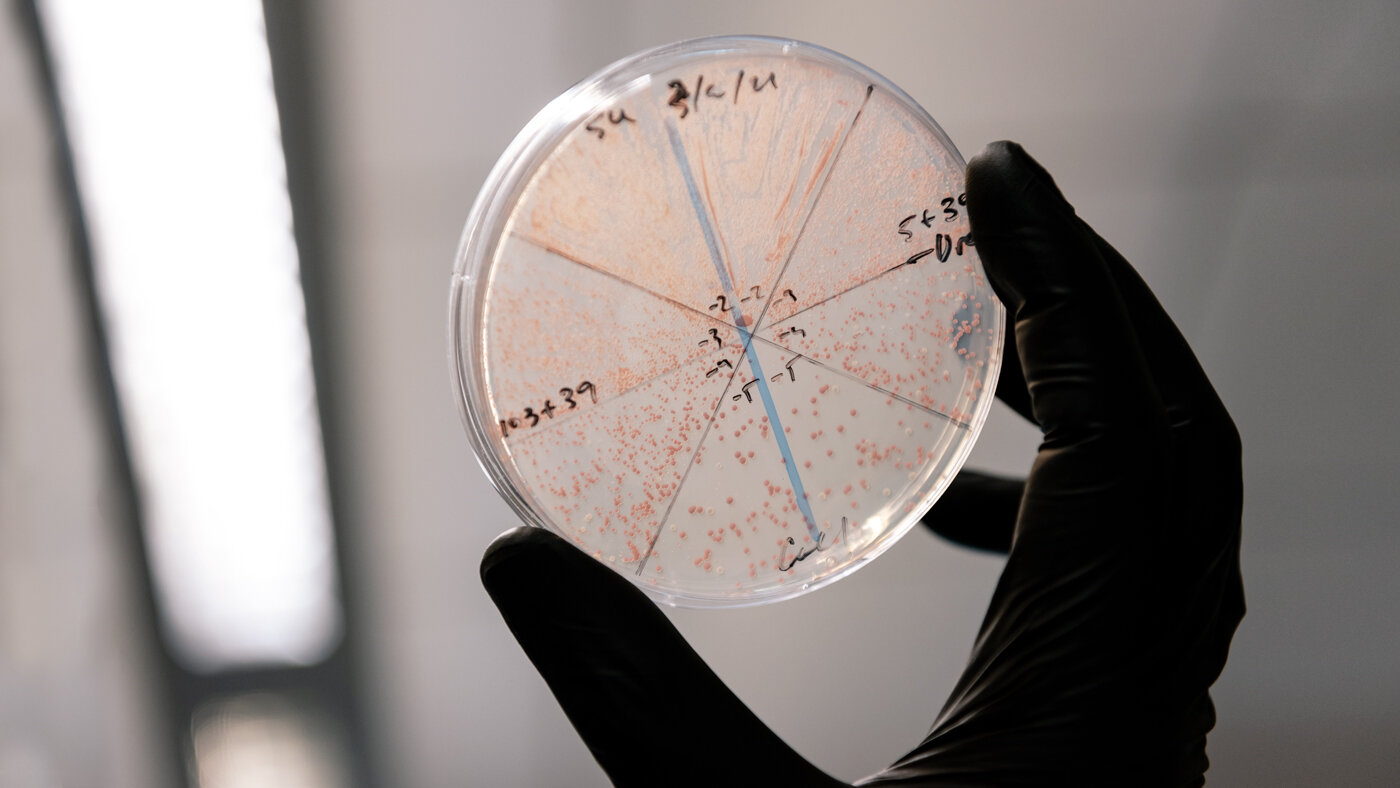
No novo estudo, o grupo de Shipman projetou retrons de E. coli para criar centenas de novas variantes. Eles testaram cada uma dessas variantes e descobriram uma série de mudanças que, juntas, levaram a um aumento de 8 a 10 vezes em quantos moldes de DNA foram eventualmente produzidos pelos retrons nas células de E. coli.
Em seguida, os pesquisadores testaram o novo sistema retron reprojetado no fungo Saccharomyces cerevisiae (fermento de padeiro) e em células humanas em cultura. Eles descobriram que esse sistema otimizado funcionava em todos os casos. Essa foi a primeira demonstração do uso de retrons em células humanas e sua portabilidade entre os tipos de células.
Uma vez que a equipe pôde ajustar exatamente quantos moldes de DNA os retrons produziram, eles também conseguiram mostrar que, quando os retrons produzem altos níveis de molde de DNA, isso aumenta a eficiência da edição de genes.
“Nosso estudo demonstra pela primeira vez que quanto mais moldes de DNA pudermos produzir, melhor será a edição do genoma”, afirmou Shipman. “Uma edição melhor e mais precisa significa, em última análise, medicamentos genômicos mais eficazes e seguros e pesquisas fundamentais mais avançadas.”
Fins terapêuticos
Segundo Shipman, os retrons são imediatamente úteis como uma ferramenta de pesquisa para editar genes em diferentes tipos de células no laboratório. Embora a plataforma ainda não esteja pronta para uso em humanos, ela também tem o potencial de ajudar a editar genes para fins terapêuticos – por exemplo, reparando mutações genéticas que causam doenças.
Uma vez que bactérias diferentes contêm retrons diferentes, seu grupo também planeja explorar se outras variações de retrons têm benefícios sobre o retron de E. coli que eles otimizaram neste estudo.
“Estamos adotando uma abordagem geral em que estamos minerando peças que encontramos nas bactérias e domesticando-as para nosso próprio uso”, disse Shipman. “Isso já foi incrivelmente frutífero para o desenvolvimento de novas ferramentas, mas acho que estamos apenas começando a colher os benefícios da aplicação dessas ferramentas em biotecnologia.”